Morino (kemio)
Aspekto
| Morino | ||
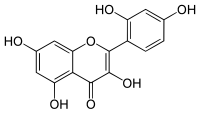 | ||
| Plata kemia strukturo de la Morino | ||
 | ||
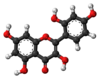
| Tridimensia kemia strukturo de la Morino | ||
 | ||
| Morino estas flava antioksidigaĵo trovata en plantoj tia kia la Morus alba[1] | ||
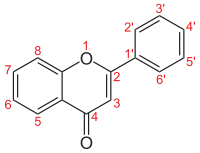 | ||
| Numerigo de la karbonaj strukturoj de la flavonoj. | ||
| Kemia formulo | ||
| CAS-numero-kodo | 480-256-0 | |
| ChemSpider kodo | 4444989 | |
| PubChem-kodo | 5281670 | |
| Merck Index | 15,6355 | |
| Fizikaj proprecoj | ||
| Aspekto | flava solidaĵo | |
| Molmaso | 302,2357 g·mol-1 | |
| Denseco | 1,799g cm−3 | |
| Fandpunkto | 285°C-290°C (malkomponiĝas) | |
| Bolpunkto | 645,5°C[2] | |
| Refrakta indico | 1,823 | |
| Ekflama temperaturo | 249,3 °C[3] | |
| Solvebleco | Akvo:0,25 g/L | |
| Mortiga dozo (LD50) | 160 mg/kg (buŝe) | |
| Sekurecaj Indikoj | ||
| Riskoj | 36/37/38 | |
| Sekureco | 36 | |
| Pridanĝeraj indikoj | ||
| Danĝero
| ||
| GHS Damaĝo Piktogramo |
| |
| GHS Signalvorto | Averto | |
| GHS Deklaroj pri damaĝoj | H301, H302, H315, H319, H335, H341 | |
| GHS Deklaroj pri antaŭgardoj | P201, P202, P261, P264, P270, P271, P280, P281, P301+310, P301+312, P302+352, P304+340, P305+351+338, P308+313, P321, P330, P332+313, P337+313, P362, P403+233, P405, P501[4] | |
(25 °C kaj 100 kPa) | ||
Morino aŭ C15H10O7 estas kemia kunmetaĵo, flava solidaĵo kiu apartenas al la familio de la flavonoidoj, abunde trovata en multaj plantoj tiaj kiaj Alba morus, Maclura pomifera, Maclura tinctoria kaj en la foliaro de la Psidium guajava. Morino estas fitokemiaĵo efika kontraŭ maljunigo, kun antivirusaj, antibakteriaj kaj antioksidigaj proprecoj. Ĝi estas hepatoprotektiva kaj restarigas la funkciojn de la hepato. Morino estas nesolvebla en akvo, solvebla en etanolo kaj iomete solvebla en duetila etero kaj acetata acido.
Sintezoj
[redakti | redakti fonton]Sintezo 1
[redakti | redakti fonton]- Preparado ekde la apigenino per aldono de du hidroksilaj grupoj, unu en la 3-a pozicio de la kromenonila grupo kaj alia en la 2-a pozicio de la fenila grupo:
Sintezo 2
[redakti | redakti fonton]- Preparado ekde la kempferolo per aldono de hidroksila grupo en la 2-a pozicio de la fenila grupo:
Sintezo 3
[redakti | redakti fonton]- Preparado ekde la krizino per aldono de du hidroksilaj grupoj, unu en la 2-a pozicio de la fenila grupo kaj alia en la 3-a pozicio de la kromenonila grupo:
Sintezo 4
[redakti | redakti fonton]- Preparado ekde la kverketino per forigo de hidroksila grupo en la 5-a pozicio de la fenila grupo kaj aldono en la 2-a pozicio de la fenila grupo:
Sintezo 5
[redakti | redakti fonton]- Preparado ekde la luteolino per forigo de hidroksila grupo en la 5-a pozicio de la fenila grupo, aldono en la 2-a pozicio de la fenila grupo kaj aldono de hidroksila grupo en la 3-a pozicio de la kromenonila grupo:
Sintezo 6
[redakti | redakti fonton]- Preparado ekde la miriketino per aldono de hidroksila grupo en la 2-a pozicio de la fenila grupo, kaj forigo de du hidroksilaj grupoj en la 3-a kaj 5-a pozicioj de la fenila grupo:
Sintezo 7
[redakti | redakti fonton]- Preparado ekde la naringenino per aldono de du hidroksilaj grupoj, unu en la 2-a pozicio de la fenila grupo, kaj alia en la 3-a pozicio de la kromenonila grupo, kaj oksidado en la 2-a pozicio de la kromenonila grupo:
Reakcioj
[redakti | redakti fonton]Reakcio 1
[redakti | redakti fonton]- Konvertado al apigenino per forigo de du hidroksilaj grupoj, unu en la 3-a pozicio de la kromenonila grupo kaj alia en la 2-a pozicio de la fenila grupo:
Reakcio 2
[redakti | redakti fonton]- Konvertado al kempferolo per forigo de hidroksila grupo en la 2-a pozicio de la fenila grupo:
Reakcio 3
[redakti | redakti fonton]- Konvertado al krizino per forigo de du hidroksilaj grupoj, unu en la 2-a pozicio de la fenila grupo kaj alia en la 3-a pozicio de la kromenonila grupo:
Reakcio 4
[redakti | redakti fonton]- Konvertado al kverketino per aldono de hidroksila grupo en la 5-a pozicio de la fenila grupo kaj forigo en la 2-a pozicio de la fenila grupo:
Reakcio 5
[redakti | redakti fonton]- Konvertado al luteolino per aldono de hidroksila grupo en la 5-a pozicio de la fenila grupo, forigo en la 2-a pozicio de la fenila grupo kaj forigo de hidroksila grupo en la 3-a pozicio de la kromenonila grupo:
Reakcio 6
[redakti | redakti fonton]- Konvertado al miriketino per forigo de hidroksila grupo en la 2-a pozicio de la fenila grupo, kaj aldono de du hidroksilaj grupoj en la 3-a kaj 5-a pozicioj de la fenila grupo:
Reakcio 7
[redakti | redakti fonton]- Konvertado al naringenino per forigo de du hidroksilaj grupoj, unu en la 2-a pozicio de la fenila grupo, kaj alia en la 3-a pozicio de la kromenonila grupo, kaj reduktado en la 2-a pozicio de la kromenonila grupo:
Literaturo
[redakti | redakti fonton]- The Good Scents Company
- Science Direct
- Nature
- Studies in Natural Products Chemistry: Bioactive Natural Products
- Natural Products for Cancer Prevention and Therapy
- Scielo
- Foreign Compound Metabolism in Mammals
- MES 24: Electrochemical Applications to Biology, Nanotechnology ...





![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3a133815724e6bf6cfb39eb43f1e6c1d96ea8d17)






![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{-2[H]}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c3ecf644066213e1758e22341790bab6a5f0de89)
![{\displaystyle {\mathsf {{\xrightarrow[{\,}]{+2[H]}}\,}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cb07d2458b96eac5ca3b93e5217b2a5b49687f0a)